Kovalent Bağ Tanımı
Kovalent Bağ Tanımı
Kimyada Kovalent Bağın Ne Olduğunu Anlamak
Kovalent Bağ Tanımı
Bir kovalent bağ, elektron çiftlerinin aralarında paylaşıldığı iki atom veya iyon arasındaki kimyasal bir bağlantıdır. Bir kovalent bağ da bir moleküler bağ olarak adlandırılabilir. Kovalent bağlar, aynı veya nispeten yakın elektronegativite değerlerine sahip iki ametal atom arasında oluşur. Bu tip bağlar, radikaller ve makromoleküller gibi başka kimyasal türlerde de bulunabilir. "Kovalent bağ" terimi ilk olarak 1939'da kullanılmaya başlamıştı, ancak Irving Langmuir 1919'da komşu atomların paylaştığı elektron çiftlerinin sayısını tanımlamak için "kovalent" terimini getirmişti.
Kovalent bağa katılan elektron çiftlerine bağ çifti veya ortak çift denir. Tipik olarak, bağlanma çiftlerini paylaşmak, her bir atomun, soy gaz atomlarında görülene benzer, sabit bir dış elektron kabuğu elde etmesine izin verir.
Kutupsal ve Nonpolar Kovalent Bağlar
İki önemli kovalent bağ tipi, polar olmayan veya saf kovalent bağlar ve polar kovalent bağlardır . Polipler bağlar, atomlar eşit olarak elektron çiftlerini paylaştıklarında ortaya çıkar. Sadece özdeş atomlar (birbiri ile aynı elektronegatiflik) gerçekten eşit paylaşımda bulunduğundan, tanım, 0.4'ten daha az bir elektronegatiflik farkına sahip herhangi bir atom arasında kovalent bağlanmayı içerecek şekilde genişletilir. Polietilen bağlara sahip moleküllerin örnekleri, H2, N2 ve CH4'tür.
Elektronegativite farkı arttıkça, bir bağdaki elektron çifti diğerine göre bir nükleusla daha yakından ilişkilidir. Elektronegativite farkı 0.4 ile 1.7 arasındaysa, bağ polardır.
Elektronegativite farkı 1.7'den büyükse, bağ iyoniktir.
Kovalent Bond Örnekleri
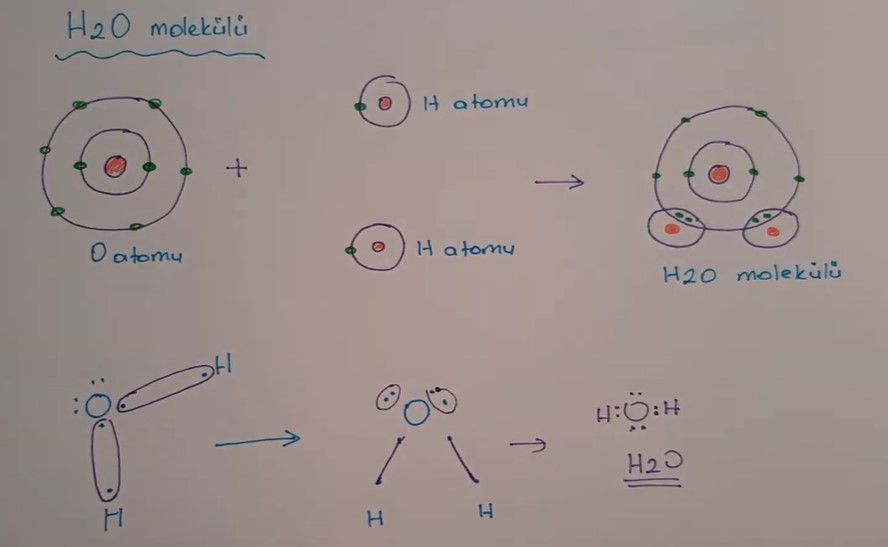
Su molekülü (H2O) içindeki oksijen ve her bir hidrojen arasında kovalent bir bağ vardır. Kovalent bağların her biri, biri hidrojen atomundan diğeri oksijen atomundan olmak üzere iki elektron içerir. Her iki atom da elektronları paylaşır.
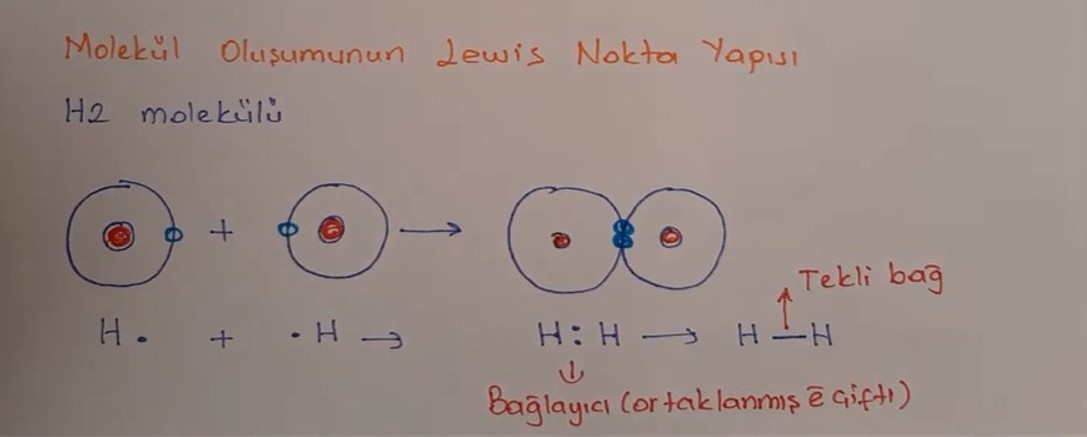
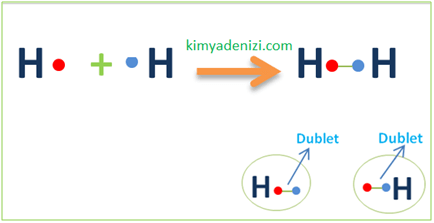
Bir hidrojen molekülü, H2, bir kovalent bağ ile birleştirilen iki hidrojen atomundan oluşur. Her hidrojen atomunun, kararlı bir dış elektron kabuğunu elde etmek için iki elektrona ihtiyacı vardır. Elektron çifti, molekülü bir arada tutan her iki atom çekirdeğinin pozitif yüküne çekilir.
Fosfor, PCl 3 veya PCl 5 oluşturabilir . Her iki durumda da, fosfor ve klor atomları kovalent bağlarla bağlanır. PCl 3 , atomların tam dış elektron kabuklarına eriştiği, beklenen soylu gaz yapısını varsayar. Yine de PC 5 aynı zamanda istikrarlıdır, bu nedenle kovalent bağların her zaman oktet kuralına uymadığını hatırlamak önemlidir.
Kovalent Bağın Tanımı ve Oluşumu

Kovalent Bağın Tanımı ve Oluşumu
(Konunun Ayrıntılı Anlatımı ve Örnekler Üzerinde Ayrıntılı Açıklamalar Haberimizin Sonundaki Videomuzdadır.)
Bu haberimizde Kovalent Bağın Tanımı ve Oluşumu konularından bahsedeceğiz.
Kovalent Bağ
Ametal atomlarının elektron ortaklaşması ile oluşturdukları bağa Kovalent Bağ denir.
Oluşan bileşikler kovalent bağlı bileşikler (veya moleküler bileşik)dir.
Kovalent bağ aynı tür ametal atomları arasında oluşabileceği gibi farklı ametal atomları arasında da olur.
Örnek: H2O, O2, F2, HF…
Atomlar arasında sadece kovalent bağ olan bileşiklerin, maddelerin en küçük yapı birimi moleküldür.
Kovalent Bağ Oluşumu
İki ametal atomu arasında;
• 1 elektron ortaklaşa kullanılıyorsa 1 tane bağ,
• 2 elektron ortaklaşa kullanılıyorsa 2 tane bağ,
• 3 elektron ortaklaşa kullanılıyorsa 3 tane bağ oluşur.
Örnekler: Örnekler üzerinde ayrıntılı-açıklayıcı anlatımlarımızı haberimiz sonundaki videomuzda bulabilirsiniz.
(Konunun ayrıntılı anlatımını ve örnekler üzerinde açıklayıcı anlatımları aşağıdaki videomuzda bulabilirsiniz.)
YouTube kanalımızdaki özel içeriklerimizi takip edin.
Abone Olun
KOVALENT BAĞ Konu Anlatımı Apolar Polar Kovalent Bağ Örnekleri Lewis 9.Sınıf
KOVALENT BAĞ Nedir? Kovalent Bağ Türleri
Ametallerin kendi aralarında elektron ortaklığı ile oluşturdukları bağlara Kovalent Bağ denir..Ametaller kendileri gibi ametal olan atomlarla bağ yapabilmek için elektron ortaklığı ile bağ oluştururlar.Elekron ortaklığı ile oluşan bu bağlar KOVALENT BAĞLAR olarak adlandırılır.
H2, O2, Cl2, H2O, HF, CH4, SO2 gibi yapılar kovalent bağla oluşan yapılardır.
Genel olarak 2 türlü Kovalent Bağ bulunur:
1.Apolar Kovalent Bağlar
2.Polar Kovalent Bağlar
Detaylı olarak inceleyelim;
1.APOLAR KOVALENT BAĞLAR KONU ANLATIMI ÇÖZÜMLÜ ÖRNEKLER
Aynı tür ametaller arasında elektron ortaklığı ile oluşan bağlar Apolar Kovalent Bağlar olarak adlandırılır. H2,O2,Cl2Br2 , O3 gibi aynı ametalden oluşmuş yapılar Apolar Kovalent Bağla oluşan yapılardır.
Apolar Kovalent Bağlar Örnekler apolar kovalent bağ örnekleri
Örnek: H2 Molekülü Lewis Yapısı Simgesi Apolar Kovalent Bağ Oluşumu(1H)
1H :1Des( Değerlik e- sayısı):1 1 nokta 1bağ
Soygaz düzenine ulaşmak için(En yakın sogaz2He) 1 bağ yapar
H2 Molekülünde 2 H olduğu için 2 tane H alırız.
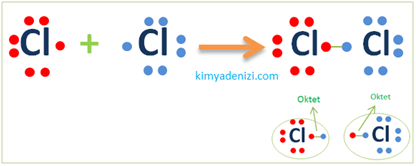
Örnek: Cl2 Molekülü Lewis Yapısı Simgesi Apolar Kovalent Bağ Oluşumu(17Cl)
17Cl :2.8.7 Des1 1 nokta 1bağ
Soygaz düzenine ulaşmak için(2.8.8) 1 bağ yapar
Cl2 Molekülünde 2 Cl olduğu için 2 tane Cl alırız.
 9.SINIF KİMYA KAZANIM TESTLERİ ÇÖZÜMLERİ İÇİN TIKLA
9.SINIF KİMYA KAZANIM TESTLERİ ÇÖZÜMLERİ İÇİN TIKLA
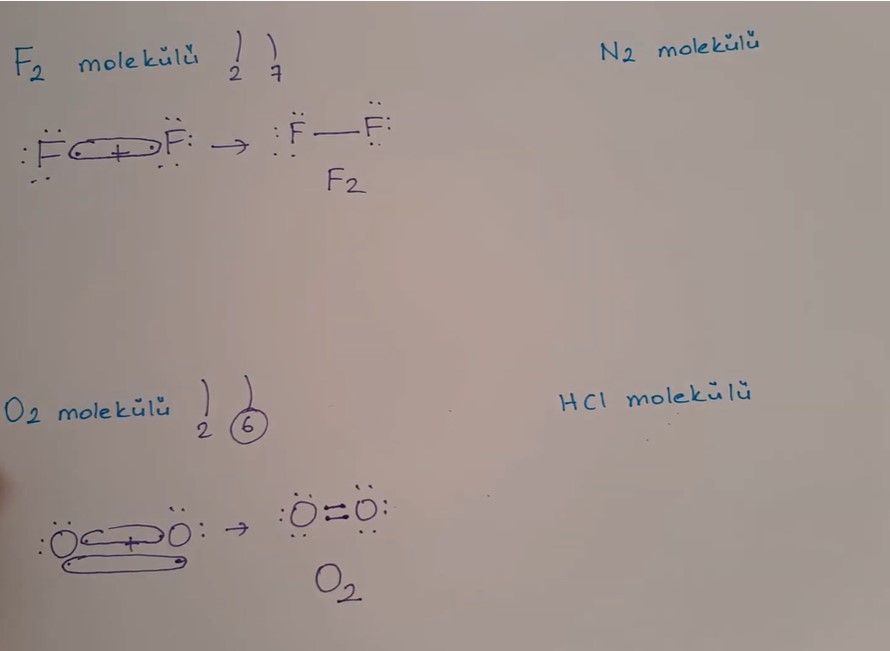
Örnek: F2 Molekülü Lewis Yapısı Simgesi Apolar Kovalent Bağ Oluşumu(9F)
9F :2.7 Des1 1 nokta 1bağ
Soygaz düzenine ulaşmak için(2.8) 1 bağ yapar
F2 Molekülünde 2 F olduğu için 2 tane F alırız.

Örnek:Br2 Molekülü Lewis Yapısı Simgesi Apolar Kovalent Bağ Oluşumu(35Br)
35Br :2.8.18.7 Des77 nokta 1bağ
Soygaz düzenine ulaşmak için(2.8.18.8) 1 bağ yapar
Br2 Molekülünde 2 Br olduğu için 2 tane Br alırız.

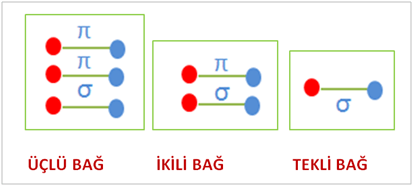
İKİLİ BAĞLAR ÜÇLÜ BAĞLAR TANIMI YAPISI OLUŞUMU
İki atom kendi arasında bağ yaparken ;
1 tane bağ yaparsa TEKLİ BAĞ
2 tane bağ yaparsa İKİLİ(ÇİFT) BAĞ
3 tane bağ yaparsa ÜÇLÜ BAĞ olarak adlandırılır.
O2 molekülünde ikil bağ, N2 molekülünde üçlü bağ oluşur.
İlk oluşan en alttaki bağ sigma bağı(σ) olarak adlandırılır
Üstünde oluşan 2.ve 3. Bağ lar ise pi π bağlarıdır
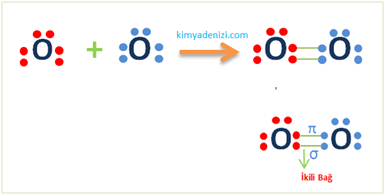
Örnek:O2 Molekülü Lewis Yapısı Simgesi Apolar Kovalent Bağ Oluşumu(8O)
8O :2.6 Des66 nokta 2bağ
Soygaz düzenine ulaşmak için(2.8) 2 bağ yapar
O2 Molekülünde 2 O olduğu için 2 tane O alırız.
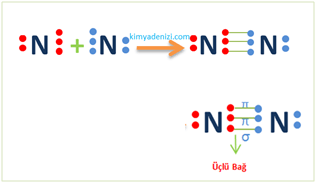
Örnek:N2 Molekülü Lewis Yapısı Simgesi Apolar Kovalent Bağ Oluşumu(7N)
7N :2.5 Des55 nokta 3bağ
Soygaz düzenine ulaşmak için(2.8) 3 bağ yapar
N2 Molekülünde 2 N olduğu için 2 tane N alırız.
2.POLAR KOVALENT BAĞLAR KONU ANLATIMI ÇÖZÜMLÜ ÖRNEKLER polar kovalent bağ örnekleri
Farklı tür ametaller arasında elektron ortaklığı ile oluşan bağlar Polar Kovalent Bağlar olarak adlandırılır. H2O,SO2,HCl2HBr ,CO2 , CS2 , gibi aynı ametalden oluşmuş yapılar Polar Kovalent Bağla oluşan yapılardır.
Örnek: HCl Molekülü Lewis Yapısı Simgesi polar Kovalent Bağ Oluşumu(1H, 17Cl)
1H :1Des(Değerlik e- sayısı):1 1 nokta 1bağ
17Cl :2.8.7 Des1 1 nokta 1bağ

Örnek: HF Molekülü Lewis Yapısı Simgesi Polar Kovalent Bağ Oluşumu(1H, 9F)
1H :1Des(Değerlik e- sayısı):1 1 nokta 1bağ
9F :2.7 Des1 1 nokta 1bağ

Örnek: H2O Molekülü Lewis Yapısı Simgesi Apolar Kovalent Bağ Oluşumu(1H, 8O)
1H :1Des(Değerlik e- sayısı):1 1 nokta 1bağ
8O :2.6 Des 6 6 nokta 2bağ MERKEZ ATOM O (Daha çok bağ yaptığı için)
Soygaz düzenine ulaşmak için(2.8) 2 bağ yapar
H2O Molekülünde 1H ve 2 O olduğu için 1 tane H 2 tane O alırız.
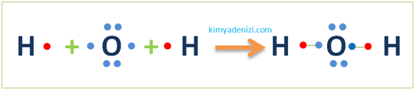
Örnek: H2S Molekülü Lewis Yapısı Simgesi PolarKovalent Bağ Oluşumu(1H, 16S)
1H :1Des (Değerlik e- sayısı):1 1 nokta 1bağ
16S :2.8.6 Des66 nokta 2bağ MERKEZ ATOM S (Daha çok bağ yaptığı için)
Soygaz düzenine ulaşmak için(2.8.8 ) 2 bağ yapar
H2S Molekülünde 1H ve 2 S olduğu için 1 tane H 2 tane S alırız.
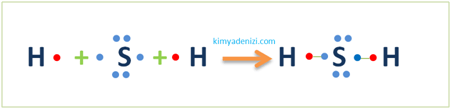
Örnek: OF2 MolekülüLewis Yapısı Simgesi PolarKovalent Bağ Oluşumu(1H, 8O)
9F :2.7 Des:7 7 nokta 1bağ
8O :2.6 Des66 nokta 2bağ MERKEZ ATOM O (Daha çok bağ yaptığı için)
Soygaz düzenine ulaşmak için(2.8) 2 bağ yapar
OF2 Molekülünde 1O ve 2 F olduğu için 1 tane O 2 tane F alırız.

Örnek: CO2 Molekülü Lewis Yapısı Simgesi PolarKovalent Bağ Oluşumu(8O)
8O :2.6 Des66 nokta 2bağ
Soygaz düzenine ulaşmak için(2.8) 2 bağ yapar
6C :2.4 Des44 nokta 4bağ
Soygaz düzenine ulaşmak için(2.8) 4 bağ yapar
Merkez atom ortaya alınacak atomdur.Çok bağ yapan atom veya atomlar merkez atomlardır.Burada C daha çok bağ yaptığı için merkez atomdur.
CO2 Molekülünde 2 O olduğu için 2 tane O,1 tane C atomu alırız.

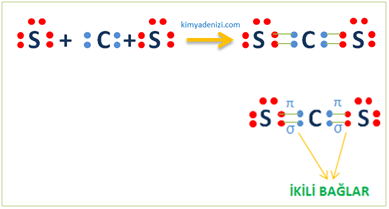
Örnek: CS2 Molekülü Lewis Yapısı Simgesi PolarKovalent Bağ Oluşumu(8O,6C )
16S :2.8.6 Des6 6 nokta 2bağ
Soygaz düzenine ulaşmak için(2.8.8 ) 2 bağ yapar
6C :2.4 Des4 4 nokta 4bağ
Soygaz düzenine ulaşmak için(2.8) 4 bağ yapar
Merkez atom ortaya alınacak atomdur.Çok bağ yapan atom veya atomlar merkez atomlardır.Burada C daha çok bağ yaptığı için merkez atomdur.
CS2 Molekülünde 2 S olduğu için 2 tane S,1 tane C atomu alırız.

Kovalent Bileşiklerin Adlandırılması Konu Anlatımı Videosu TIKLA İzle Kimya DeniziYOUTUBE

Kovalent Bileşiklerin Adlandırılması Ders Notları ve Test Pdf İndirmek İçin Yukardaki Linki Tıklayınız.
