Rutherford Atom Modeli Maketi
Dalton Atom Modeli Özellikleri Doğruları Eksiklikleri Varsayımları Yanlışları
Dalton Atom Modeli John Dalton tarafından ortaya çıkmış bir modeldir
– Aynı anda Matematik ve Doğa Felsefesi Öğretmeni olan İngiliz kimyacı John Dalton ; kendine ait atom fikrini ilk kez 1808 yılında ortaya atmıştır.
– Kütlenin korunumu, Sabit Oranlar Yasasını da inceleyerek bazı deneyler yapmıştır.Yaptığı deneyler sonucunda;maddenin tek parça olamayacığını içerisinde görülemeyen küçük yapılar olması gerektiğini düşünmüştür.
– Bu görülemeyen küçük yapılar için de Democritus gibi ATOM kelimesini kullanmıştır.
– Dalton Atom Modeli ;atomları bilardo topları gibi yuvarlak, sert ve özelliği olmayan küreler olarak tanımlamıştır.
– Dalton bu çalışmalarla beraber ilk Bilimsel Atom Modelini ortaya atmış oldu.

Dalton atom modeli maketi,resmi
Dalton Atom Modeli Özellikleri Varsayımları
Taneciksiz atom modeli olarak da adlandırılan Dalton Atom Modelini maddeler halinde kısaca özetleyecek olursak;
– Bütün maddeler atomlardan oluşmuştur.
– Atomlar içi dolu, bölünemez kürelerdir.
– Elementler atom denilen bölünemeyen çok küçük taneciklerden oluşmuştur.
– Bir elementin bütün atomlarının kütlesi ve diğer özellikleri özdeştir,aynıdır..
– Ancak bir elementin atomları diğer bütün elementlerin atomlarından farklıdır.
– Farklı elementlerin atomlarının kütleleri farklıdır.
– Kimyasal tepkimeler, yalnızca atomların birbirinden ayrılması, birbirleri ile birleşmesi ya da yeniden düzenlenmesinden ibarettir. Kimyasal tepkimelerde, bir element atomu diğer bir elementin atomuna dönüşemez, parçalanamaz ve yok olamaz.
– Bir elementin atomları ile diğer bir elementin atomları ile birleşerek bileşikleri meydana getirirler. Elementler bileşik oluştururken atomlar tam sayılı olarak birleşirler (sabit oranlar yasası).
Dalton Atom Modelinin Diğer Kanunlarla ilişkisi;
– Dalton, Sabit Oranlar Yasasını kabul etmiş ve doğrulamıştır.
– Dalton,Kütlenin Korunumu Yasasını da kabul etmiş ve doğrulamıştır.
Dalton Atom Modelinin Eksiklikleri ve Yanlışları
Dalton Atom Modelindeki bazı yanlışlar ve eksiklikleri şöylece sıralayabiliriz;
– Elementleri oluşturan atomlar bilardo topları gibi yuvarlak ve özelliği olmayan içi dolu kürecikler değildir. Atom altı parçacıklar olarak adlandırdığımız proton, nötron, elektron keşfedildikten sonra bu görüş önemini yitirmiştir.
– Dalton’un teorisindeki “bir elementin bütün atomları özdeştir” görüşü izotopları açıklayamamıştır. İzotop atomların proton sayıları aynı olduğu halde nötron sayıları aynı olmayabilir.
– Atomların parçalanamayacağı görüşü de çekirdek tepkimeleri bulunduktan sonra önemini yitirmiştir.Atomlar parçalanamamış olsaydı atom bombası,nükleer çalışmalar gibi çalışmalar yapılamazdı
Dalton’un da önerdiği gibi atomlar parçalanamaz görüşü kimyasal tepkimelerde doğrudur ama çekirdek tepkimelerinde doğru değildir Çünkü çekirdek tepkimelerinde atomun parçalandığı ispatlanmıştır.
– Proton, nötron ve elektronun varlığı belirtilmemiştir yani taneciksiz atom modelidir.
- Nötronu bulamamıştır.
- Elektronların yerlerini ve hareketlerini tam olarak açıklayamamıştır.
Rutherford atom modeli ile Modern Atom Teorisi ve Bohr atom modelinin temelleri atılmıştır.
Kaynakça[değiştir ATOM TEORİLERİ, ATOM MODELLERİ, DALTON, THOMSON, RUTHERFORD, BOHR ATOM MODELİ KONU ANLATIMI
DALTON ATOM TEORİSİ
Kimyasal birleşmenin yukarıdaki iki yasasından yararlanan John Dalton 1803 - 1808 tarihleri arasında bir atom kuramı geliştirdi.Dalton Kütlenin Korunumu Yasası ve Sabit Oranlar Yasasından yola çıkarak maddeyi oluşturan ve onun bütün özelliklerini gösteren çok küçük parçacıkların olduğu yorumunu yaparakKatlı Oranlar Kanunu’nu ortaya atmıştır:
Katlı Oranlar Kanunu, iki element birden fazla bileşik oluşturuyorsa, birinin belli bir miktarına karşılık, diğerinin değişken miktarları arasında küçük ve tam sayılarla ifade edilen bir oran vardır, şeklinde tanımlanabilir.
Katlı Oranlar Kanunu, kimyasal elementlerin atom adı verilen parçalanamaz parçacıklardan oluştuğunu ve her elementin atomlarının kütlesinin aynı olduğunu gösterir.
Dalton’a göre:
1. Bir elementin bütün atomları şekil, büyüklük ve kütle yönüyle aynıdır.
2. Atomlar içi dolu küreciklerdir.
3. Bilinen en küçük parçacık atomdur.
4. Atomlar parçalanamaz, yeniden oluşturulamaz.
5. Atomlar belirli oranlarda birleşerek molekülleri meydana getirir. Elementin bütün atomları aynı olduğu gibi bir bileşiğin de bütün atomları aynıdır.
Dalton teorisinde pek çok yanlışlık ve eksiklik olmasına rağmen çok önemlidir.Kendisinden sonra gelen bilim adamlarına bir kapı aralamış, fikir ortaya atarak tartışılmasını sağlamıştır. Böylece daha doğruya ulaşma imkanı sağlamıştır.
Dalton Atom Teorisindeki Eksiklik ve Hatalar :
1. Bir elementin bütün atomları aynı değildir. O dönemde nötron tanecikleri tespit edilemediği için izotop atomların farkına varılamadı. Bir elemente ait bütün atomların proton ve elektron sayısı aynı olmak zorundadır. Nötron sayısı farklı olsa da aynı elemente aittir, fakat farklı atomdur.
2. Atomların içi dolu değildir. Aksine boşluklu yapıya sahiptir.
3. Bilinen en küçük parçacık atom değildir. Günümüzde atom çekirdeğini oluşturan 70 çeşit parçacığın var olduğu ve bunların bilinen 50 hareketinin olduğu ifade edilmektedir.
4. Bir elementin bütün atomları aynı olmadığı gibi bir bileşiğin bütün molekülleri de aynı değildir.
THOMSON ATOM MODELİ
Havası alınmış tüplerin iki ucuna yerleştirilen elektrotlara (katot ve anot) yüksek gerilim uygulandığında katottan anoda doğru ışınların yayıldığını ve bu ışınların manyetik alanda da pozitif kutbun etkisiyle sapmaya uğradığını tespit etmiştir. Katot ışınları adı verilen bu ışınlar negatif elektrikle yüklüydü. Thomson, bu ışınların sapmalarından yararlanarak yük/kütle oranlarını hesapladı. Bu oran, iyonların ölçülen yük/kütle oranlarına göre çok büyüktü. Bu sonuca göre katot ışını birimleri negatif yüklü, çok küçük kütleli atom içi parçacıklardı. Atomda negatif (-) yüklü parçacıklar olduğuna göre pozitif (+) yüklü parçacıklarda, yani protonlarda olmalıydı.
Bu tespitlerden sonra Thomson atomda (+) ve (-) yüklü parçacıkların var olduğunu ve bunların atomda rasgele dağıldığını ifade etmiştir.Rasgele dağılmayı da üzümlü kek örneğiyle izah etmiştir.


Thomson atom teorisine göre:
1.Atom protonlardan oluşmuş küre şeklindedir.Protonlar (+1) birim yüke,elektronlar ise (-1) birim yüke sahiptir.
2.Elektronlar atomun içinde homojen olarak dağılmıştır.
3.Nötr atomda proton sayısı kadar elektron bulunmaktadır.
4. Elektronların kütlesi protonların kütlesinden çok küçüktür. Bu nedenle ihmal edilebilir.
5. Protonlar ve elektronlar atomda rasgele dağılmıştır.
RUTHERFORD ATOM TEORİSİ

Rutherford çok ince (10-6 cm) altın levhaya alfa (α) tanecikleri (Helyum çekirdeği) göndermiştir. Bu taneciklerin çok az bir kısmı aynen yansırken bazıları belli açılarla yansımış fakat büyük bir bölümü aynen geçmiştir.
Yapılan deney sonucuna göre :
1. Atomdaki pozitif(+) yükler çekirdek denen çok küçük bir bölgededir.
2. Alfa (α) taneciklerinin sapmasına yol açan yoğun kesim çekirdekte toplanmıştır.
3. Çekirdekteki yük miktarı, bir elementin bütün atomları için aynı, farklı atomları için farklıdır.
4. Elektronlar çekirdekten oldukça uzakta yer alırlar. Elektronların bulunduğu hacim, çekirdeğin bulunduğu hacimden çok büyüktür. Atomun büyük bir kısmı boşluklu yapıya sahiptir.
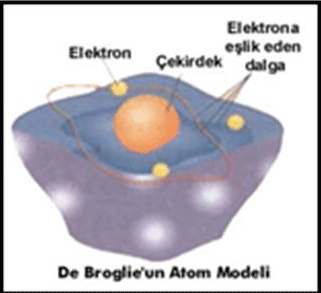
BOHR ATOM MODELİ
Bohr yaptığı çalışmalarda Rutherford atom modeline göre,elektronların çekirdek etrafında dönmeleri ile enerji yaymaları sonucunda enerjilerinin azalacağını ve çekirdek üzerine düşeceklerini hesapladı, fakat böyle bir elektron düşmesi gerçekleşmediği için Rutherford atom teorisinin bazı yanlışlıklarının olması gerektiğini fark etti ve bu teoriye bazı eklemeler yaptığı yeni bir atom modeli ortaya attı.Rutherford, elektronların çekirdekten oldukça uzakta yer aldığını ifade etmişti. Bohr da elektronların ne kadar uzakta yer aldıklarını, çekirdek etrafındaki hareketlerini ve enerjilerini incelemiştir.Araştırmaları 1H, 2He ve 3Li+ gibi küçük atom ve iyonlar üzerinde olmuştur.Elde ettiği sonuçlar küçük atomlar için doğru iken büyük atomlar için hatalı olmuştur.
Bohr Atom Teorisine Göre:
1. Elektronlar çekirdek çevresinde rasgele dairesel bir yörüngede değil, çekirdekten oldukça uzakta sabit bir enerjiye sahip dairesel yörüngelerde hareket ederler.
2. Elektronlar çekirdek etrafında sabit enerjili dairesel yörüngelerde (orbitallerde) hareket ederler. Buyörüngelere Enerji Seviyesi adı verilir.
3. Bohr atom kuramına göre, hidrojen atomunun 1 elektronu en düşük enerji düzeyi olan n=1 de bulunur. Buna Temel hâl denir. Elektron temel hâlden uzaklaştırılırken n=2, n=3, n=4 hâllerinden birine getirilirse uyarılmış olur. Uyarılmış hâlde elektronun enerjisi daha fazla olur.Daha az enerjili (uyarılmış) duruma göre kararsızdır. Elektrona verilen enerji kaldırıldığında düşük enerjili uyarılmamış (kararlı duruma) hâle geçer. Bu sırada iki enerji seviyesi farkı kadar ışın yayınlar. Elektronlar yüksek enerji düzeyinden düşük enerji düzeyine geçerken enerji yayarlar. Düşük enerji düzeyinden yüksek enerji düzeyine geçerken de enerji alırlar.
NOT: Bir atomun elektronları dışardan enerji alarak yüksek enerji düzeyine yükselirse bu atoma "uyarılmış atom" denir. Bu olaya uyarılma denir. Uyarılmış atom yüksek enerji düzeyinden düşük enerji düzeyine geçtiğinde iki enerji düzeyi arasındaki enerji farkına eşit bir ışık (foton) yayınlar.Bu yayınlanan ışınlar her element için karakteristik özellik gösterir.Yayınlanan ışının şiddetine göre cisimlerin bazılarını mikroskop bazılarını ise gözümüzle gözlemleyebiliriz.

Gözümüz yayınlanan bu ışınların sadece dalga boyu(λ ) 7.10−5 cm olan kırmızı ışık ile 4,5.10−5 cm olan mor ışık arasındaki kısmı görür.Daha kısa dalga boylu ışımaları duyu organlarımızla algılayamayız.
4. Çekirdekten uzaklaştıkça elektronun enerjisi de artar. Elektronlar, bulundukları enerji seviyesinin enerjisine sahiptir. Enerji seviyeleri atom çekirdeğine yakınlığına göre n = 1, 2, 3, 4, 5, 6 gibi tamsayılarla veya K, L, M, N, O, P, Q gibi harflerle ifade edilirler.
Yörünge sayısı (n) olmak üzere yörüngenin sahip olduğu enerji; -18
En = -2,18.10 J bağıntısı ile bulunur.
n2
Bu konuya bakanlar bunlara da baktı
- ATOM TEORİLERİ, ATOM MODELLERİ, DALTON, THOMSON, RUTHERFORD, BOHR ATOM MODELİ KONU ANLATIMI
- Atom modelleri konu anlatımı
- ATOM, ATOMUN YAPISI, ATOMUN ÖZELLİKLERİ KONU ANLATIMI
- Geçmişten Günümüze Atom Modellerinin Serüveni
- Atom Modellerinin Tarihsel Serüveni, Atomun yapısı çözümlü sorular, test soruları ve cevapları - 27 Soru
- 7. Sınıf Kemik Kas, Kuvvet ve Hareket, Madde, Elektrik, Sistemler, Duyu Organları, Devre, Atom, Nötron, Elektron, Proton, İletken ile İlgili Şiirler
- 7. Sınıf Hücre, Hücre Organelleri, Kuvvet ve Hareket, Madde, Maddenin Halleri, Elektrik, Sistemler, Duyu Organları, Devre, Basit Makine, Atom, Enerji, Elektron - Proton ile İlgili Şiirler
- 7. Sınıf Fen ve Teknoloji Dersi John Dalton'un Hayatı, Eserleri
- 3. Sınıf Matematik Geometrik Cisim Modelleri Proje Performans Görevleri
- 1. Sınıf Matematik Örüntü Modelleri Oluşturma Proje Performans Görevi 1
- 1. Sınıf Matematik Örüntü Modelleri Oluşturma Proje Performans Görevi
- 3. Sınıf Matematik Geometrik Cisim Modelleri Çizme Proje Performans Görevi 1
- 2. Sınıf Matematik Geometrik Modelleri Ayırt Etme Proje Performans Görevi
- Okul Gelişim Modeli Dökümanları
- Basit Makine Modeli Projesi - 7. Sınıf
- 1. Sınıf Panoya Asmak İçin Mevsim Ay Gün Modeli
- Dolaşım Sistemi Modeli - Maketi Nasıl Yapılır
nest...
ATOM TEORİLERİ, ATOM MODELLERİ, DALTON, THOMSON, RUTHERFORD, BOHR ATOM MODELİ KONU ANLATIMI
DALTON ATOM TEORİSİ
Kimyasal birleşmenin yukarıdaki iki yasasından yararlanan John Dalton 1803 - 1808 tarihleri arasında bir atom kuramı geliştirdi.Dalton Kütlenin Korunumu Yasası ve Sabit Oranlar Yasasından yola çıkarak maddeyi oluşturan ve onun bütün özelliklerini gösteren çok küçük parçacıkların olduğu yorumunu yaparakKatlı Oranlar Kanunu’nu ortaya atmıştır:
Katlı Oranlar Kanunu, iki element birden fazla bileşik oluşturuyorsa, birinin belli bir miktarına karşılık, diğerinin değişken miktarları arasında küçük ve tam sayılarla ifade edilen bir oran vardır, şeklinde tanımlanabilir.
Katlı Oranlar Kanunu, kimyasal elementlerin atom adı verilen parçalanamaz parçacıklardan oluştuğunu ve her elementin atomlarının kütlesinin aynı olduğunu gösterir.
Dalton’a göre:
1. Bir elementin bütün atomları şekil, büyüklük ve kütle yönüyle aynıdır.
2. Atomlar içi dolu küreciklerdir.
3. Bilinen en küçük parçacık atomdur.
4. Atomlar parçalanamaz, yeniden oluşturulamaz.
5. Atomlar belirli oranlarda birleşerek molekülleri meydana getirir. Elementin bütün atomları aynı olduğu gibi bir bileşiğin de bütün atomları aynıdır.
Dalton teorisinde pek çok yanlışlık ve eksiklik olmasına rağmen çok önemlidir.Kendisinden sonra gelen bilim adamlarına bir kapı aralamış, fikir ortaya atarak tartışılmasını sağlamıştır. Böylece daha doğruya ulaşma imkanı sağlamıştır.
Dalton Atom Teorisindeki Eksiklik ve Hatalar :
1. Bir elementin bütün atomları aynı değildir. O dönemde nötron tanecikleri tespit edilemediği için izotop atomların farkına varılamadı. Bir elemente ait bütün atomların proton ve elektron sayısı aynı olmak zorundadır. Nötron sayısı farklı olsa da aynı elemente aittir, fakat farklı atomdur.
2. Atomların içi dolu değildir. Aksine boşluklu yapıya sahiptir.
3. Bilinen en küçük parçacık atom değildir. Günümüzde atom çekirdeğini oluşturan 70 çeşit parçacığın var olduğu ve bunların bilinen 50 hareketinin olduğu ifade edilmektedir.
4. Bir elementin bütün atomları aynı olmadığı gibi bir bileşiğin bütün molekülleri de aynı değildir.
THOMSON ATOM MODELİ
Havası alınmış tüplerin iki ucuna yerleştirilen elektrotlara (katot ve anot) yüksek gerilim uygulandığında katottan anoda doğru ışınların yayıldığını ve bu ışınların manyetik alanda da pozitif kutbun etkisiyle sapmaya uğradığını tespit etmiştir. Katot ışınları adı verilen bu ışınlar negatif elektrikle yüklüydü. Thomson, bu ışınların sapmalarından yararlanarak yük/kütle oranlarını hesapladı. Bu oran, iyonların ölçülen yük/kütle oranlarına göre çok büyüktü. Bu sonuca göre katot ışını birimleri negatif yüklü, çok küçük kütleli atom içi parçacıklardı. Atomda negatif (-) yüklü parçacıklar olduğuna göre pozitif (+) yüklü parçacıklarda, yani protonlarda olmalıydı.
Bu tespitlerden sonra Thomson atomda (+) ve (-) yüklü parçacıkların var olduğunu ve bunların atomda rasgele dağıldığını ifade etmiştir.Rasgele dağılmayı da üzümlü kek örneğiyle izah etmiştir.
| Thomson atom teorisine göre: 1.Atom protonlardan oluşmuş küre şeklindedir.Protonlar (+1) birim yüke,elektronlar ise (-1) birim yüke sahiptir. 2.Elektronlar atomun içinde homojen olarak dağılmıştır. 3.Nötr atomda proton sayısı kadar elektron bulunmaktadır. 4. Elektronların kütlesi protonların kütlesinden çok küçüktür. Bu nedenle ihmal edilebilir. 5. Protonlar ve elektronlar atomda rasgele dağılmıştır. |
RUTHERFORD ATOM TEORİSİ


Rutherford çok ince (10-6 cm) altın levhaya alfa (α) tanecikleri (Helyum çekirdeği) göndermiştir. Bu taneciklerin çok az bir kısmı aynen yansırken bazıları belli açılarla yansımış fakat büyük bir bölümü aynen geçmiştir.
Yapılan deney sonucuna göre :
1. Atomdaki pozitif(+) yükler çekirdek denen çok küçük bir bölgededir.
2. Alfa (α) taneciklerinin sapmasına yol açan yoğun kesim çekirdekte toplanmıştır.
3. Çekirdekteki yük miktarı, bir elementin bütün atomları için aynı, farklı atomları için farklıdır.
4. Elektronlar çekirdekten oldukça uzakta yer alırlar. Elektronların bulunduğu hacim, çekirdeğin bulunduğu hacimden çok büyüktür. Atomun büyük bir kısmı boşluklu yapıya sahiptir.
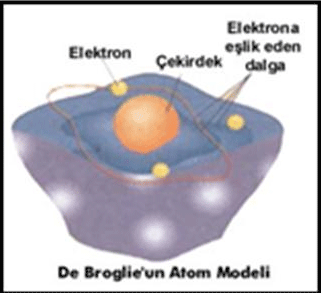
BOHR ATOM MODELİ
| Bohr yaptığı çalışmalarda Rutherford atom modeline göre,elektronların çekirdek etrafında dönmeleri ile enerji yaymaları sonucunda enerjilerinin azalacağını ve çekirdek üzerine düşeceklerini hesapladı, fakat böyle bir elektron düşmesi gerçekleşmediği için Rutherford atom teorisinin bazı yanlışlıklarının olması gerektiğini fark etti ve bu teoriye bazı eklemeler yaptığı yeni bir atom modeli ortaya attı.Rutherford, elektronların çekirdekten oldukça uzakta yer aldığını ifade etmişti. Bohr da elektronların ne kadar uzakta yer aldıklarını, çekirdek etrafındaki hareketlerini ve enerjilerini incelemiştir.Araştırmaları 1H, 2He ve 3Li+ gibi küçük atom ve iyonlar üzerinde olmuştur.Elde ettiği sonuçlar küçük atomlar için doğru iken büyük atomlar için hatalı olmuştur.
|
Bohr Atom Teorisine Göre:
1. Elektronlar çekirdek çevresinde rasgele dairesel bir yörüngede değil, çekirdekten oldukça uzakta sabit bir enerjiye sahip dairesel yörüngelerde hareket ederler.
2. Elektronlar çekirdek etrafında sabit enerjili dairesel yörüngelerde (orbitallerde) hareket ederler. Buyörüngelere Enerji Seviyesi adı verilir.
3. Bohr atom kuramına göre, hidrojen atomunun 1 elektronu en düşük enerji düzeyi olan n=1 de bulunur. Buna Temel hâl denir. Elektron temel hâlden uzaklaştırılırken n=2, n=3, n=4 hâllerinden birine getirilirse uyarılmış olur. Uyarılmış hâlde elektronun enerjisi daha fazla olur.Daha az enerjili (uyarılmış) duruma göre kararsızdır. Elektrona verilen enerji kaldırıldığında düşük enerjili uyarılmamış (kararlı duruma) hâle geçer. Bu sırada iki enerji seviyesi farkı kadar ışın yayınlar. Elektronlar yüksek enerji düzeyinden düşük enerji düzeyine geçerken enerji yayarlar. Düşük enerji düzeyinden yüksek enerji düzeyine geçerken de enerji alırlar.
NOT: Bir atomun elektronları dışardan enerji alarak yüksek enerji düzeyine yükselirse bu atoma "uyarılmış atom" denir. Bu olaya uyarılma denir. Uyarılmış atom yüksek enerji düzeyinden düşük enerji düzeyine geçtiğinde iki enerji düzeyi arasındaki enerji farkına eşit bir ışık (foton) yayınlar.Bu yayınlanan ışınlar her element için karakteristik özellik gösterir.Yayınlanan ışının şiddetine göre cisimlerin bazılarını mikroskop bazılarını ise gözümüzle gözlemleyebiliriz.

Gözümüz yayınlanan bu ışınların sadece dalga boyu(λ ) 7.10−5 cm olan kırmızı ışık ile 4,5.10−5 cm olan mor ışık arasındaki kısmı görür.Daha kısa dalga boylu ışımaları duyu organlarımızla algılayamayız.
4. Çekirdekten uzaklaştıkça elektronun enerjisi de artar. Elektronlar, bulundukları enerji seviyesinin enerjisine sahiptir. Enerji seviyeleri atom çekirdeğine yakınlığına göre n = 1, 2, 3, 4, 5, 6 gibi tamsayılarla veya K, L, M, N, O, P, Q gibi harflerle ifade edilirler.
Yörünge sayısı (n) olmak üzere yörüngenin sahip olduğu enerji; -18
En = -2,18.10 J bağıntısı ile bulunur.
n2
- ATOM TEORİLERİ, ATOM MODELLERİ, DALTON, THOMSON, RUTHERFORD, BOHR ATOM MODELİ KONU ANLATIMI
- Atom modelleri konu anlatımı
- ATOM, ATOMUN YAPISI, ATOMUN ÖZELLİKLERİ KONU ANLATIMI
- Geçmişten Günümüze Atom Modellerinin Serüveni
- Atom Modellerinin Tarihsel Serüveni, Atomun yapısı çözümlü sorular, test soruları ve cevapları - 27 Soru
- 7. Sınıf Kemik Kas, Kuvvet ve Hareket, Madde, Elektrik, Sistemler, Duyu Organları, Devre, Atom, Nötron, Elektron, Proton, İletken ile İlgili Şiirler
- 7. Sınıf Hücre, Hücre Organelleri, Kuvvet ve Hareket, Madde, Maddenin Halleri, Elektrik, Sistemler, Duyu Organları, Devre, Basit Makine, Atom, Enerji, Elektron - Proton ile İlgili Şiirler
- 7. Sınıf Fen ve Teknoloji Dersi John Dalton'un Hayatı, Eserleri
- 3. Sınıf Matematik Geometrik Cisim Modelleri Proje Performans Görevleri
- 1. Sınıf Matematik Örüntü Modelleri Oluşturma Proje Performans Görevi 1
- 1. Sınıf Matematik Örüntü Modelleri Oluşturma Proje Performans Görevi
- 3. Sınıf Matematik Geometrik Cisim Modelleri Çizme Proje Performans Görevi 1
- 2. Sınıf Matematik Geometrik Modelleri Ayırt Etme Proje Performans Görevi
- Okul Gelişim Modeli Dökümanları
- Basit Makine Modeli Projesi - 7. Sınıf
- 1. Sınıf Panoya Asmak İçin Mevsim Ay Gün Modeli
- Dolaşım Sistemi Modeli - Maketi Nasıl Yapılır
Bu konuya bakanlar bunlara da baktı